Los desconocidos procesos mecánicos del equilibrio celular
2023
Luciana Bruno
Investigadoras del Instituto de Cálculo lograron ahondar en la mecánica que define las relaciones entre el citoesqueleto de las células eucariotas y esa suerte de “usina energética” que vehiculiza todo el funcionamiento celular: las mitocondrias. En base al estudio de células de la piel de ranas africanas, mostraron -desde la biofísica- que la perturbación de los distintos andamios que definen el citoesqueleto impacta diferencialmente en aspectos como longitud, rigidez, movilidad y organización mitocondrial.
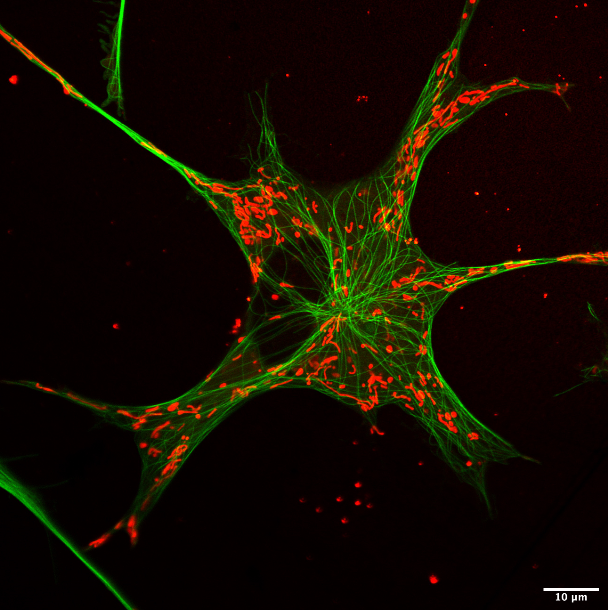
Los movimientos y cambios morfológicos constantes de las mitocondrias -suerte de “central energética” dentro de las células- empiezan, de a poco, a encontrar una explicación sólida desde la biofísica. En particular, tras una publicación de investigadoras de la Facultad de Ciencias Exactas y Naturales de la UBA en la revista Scientific Reports (del grupo Nature) que, con una especificidad novedosa, profundizaron en la relación mecánica de esas organelas con las distintas partes del citoesqueleto.
Se trata de un área explorada por otros equipos de investigación, pero hasta ahora no se había llegado al nivel de detalle al que arribaron las científicas: comprender, desde el punto de vista mecánico, cómo interactúan -cada una por separado- las tres redes del citoesqueleto en su vínculo con las mitocondrias, organelas decisivas para vehiculizar el vital proceso de la respiración celular.
Escrito por las físicas Luciana Bruno*, investigadora independiente del Conicet, y la estudiante de doctorado Agustina Belén Fernández Casafuz, además de por la bióloga, doctora en química biológica e investigadora Asistente María Cecilia De Rossi, el paper deja claro su hallazgo en la propia afirmación plasmada en el título: “Mitochondrial cellular organization and shape fluctuations are differentially modulated by cytoskeletal networks”, o en español, “La organización y fluctuaciones en la forma de las mitocondrias celulares están moduladas diferencialmente por las redes del citoesqueleto”.
“Hace más de diez años nos propusimos entender cómo se transportaban las organelas dentro de las células, pero en cierto momento pusimos nuestro interés en el efecto que podría generar en ellas el movimiento de ciertos filamentos del citoesqueleto, los llamados microtúbulos. Como las organelas se mueven a lo largo de ellos, y éstos a su vez se movilizan por la propia dinámica, se nos hizo claro que había que estudiar los dos movimientos en simultáneo”, adelantó Bruno.
Organelas con historia
Brotaba la idea de una relación entre esos fenómenos, en especial “considerando que ambas estructuras, organelas y microtúbulos, están vinculadas a través de motores moleculares, básicamente, proteínas que transforman energía química en movimiento y que son las responsables del traslado de las organelas”. Para graficarlo de un modo simple, es “tal como ocurre con un camión (motor) que transporta cierta carga (las mitocondrias) sobre una autopista (en este caso, los microtúbulos)”.
Además, a partir de simulaciones numéricas, las expertas sumaron otro ingrediente fundamental: se propusieron estudiar la rigidez de las organelas transportadas, partiendo de la premisa de que, “si las organelas eran rígidas, debía haber un desplazamiento, pero si eran flexibles, lo razonable era que ocurriera, además, una deformación”, detalló la investigadora.
Todo esto condujo a la decisión de profundizar en un tipo puntual de organelas, las mitocondrias: “Por su característica flexibilidad y capacidad de deformación y dado su rol central dentro de las células, nos pareció un sistema ideal. ¡Hermoso también!”
Un andamio celular
Hay que destacar que en la línea celular estudiada, las mitocondrias se presentaron mayormente como organelas alargadas y deformables, o como ilustró Bruno, “con la forma de gusanitos”.
Con el horizonte puesto en desentrañar los cambios dinámicos (distribución, forma y organización) experimentados por estas organelas y en base a imágenes microscópicas de células de piel de ranas africanas (Xenopus laevis), las autoras lograron comprender el protagonismo de las tres redes que hacen al andamiaje intracelular, más conocido como “citoesqueleto”, una amplia red de proteínas intracelulares -tubulares o filamentosas, según el caso- presente en las células eucariotas.
Para lograrlo afectaron químicamente, por pasos, cada red del citoesqueleto, de modo de ir “apagando” o desactivando -de manera selectiva- unos y otros filamentos y túbulos, y poder observar, luego, los efectos en cuanto a la organización, morfología y fluctuaciones en la forma de las mitocondrias.
Se obtuvieron imágenes de las células mediante microscopía de superresolución (SR) de barrido Airy para caracterizar el condrioma (el conjunto de mitocondrias que integra una célula), mientras que usaron microscopía confocal para ver las fluctuaciones temporales en la forma y movilidad.
El puntapié inicial fue apuntar a la red del citoesqueleto compuesta por microtúbulos (“tienen una forma cilíndrica y son más bien rígidos”, detalló Bruno). Luego, en una segunda instancia, pusieron la mirada en la red de filamentos de actina (“más finos y flexibles”, sumó). Y para comprender los efectos de la red de filamentos intermedios (o “de vimentina”) trabajaron con células mutadas, que directamente no expresaban esos filamentos.
Yendo de atrás para adelante, de los filamentos intermedios concluyeron un rol más bien secundario, pero los filamentos de actina y los microtúbulos se llevaron casi toda la atención.
Efectos a la vista
“Queríamos discriminar el rol de cada grupo de filamentos de manera aislada. Para eso llevamos a cabo un proceso de despolimerización con distintas drogas. Con los microtúbulos usamos nocodazol, que los elimina o, más bien, los rompe. Aplicamos una dosis muy baja, de modo de eliminar algunos pero no todos y, así, no alterar tanto a las mitocondrias”, explicó.
“En cuanto a la actina, aplicamos otra droga, latrunculina, que despolimeriza esa red en particular y, de ese modo, sólo quedaron 'andando' los microtúbulos y filamentos intermedios”, distinguió.
¿Las conclusiones? Que los microtúbulos y los filamentos de actina son las redes que más cambios ejercen sobre las mitocondrias. “Obviamente trabajamos con un grupo control para comparar lo que veíamos”, aclaró Bruno.
Y como al eliminar la mayoría de los microtúbulos las organelas se “acomodaron” de un modo diferente, el trabajo también ratificó información de investigaciones previas, como que “la red de microtúbulos es la que en mayor medida organiza la población mitocondrial”.
Por último, verificaron que la eliminación de los filamentos de actina aumentaba la movilidad de las mitocondrias: “Atribuimos a la actina el rol de ser una red que las tiene confinadas. Al estar encerradas, las mitocondrias se presentan de un modo curvado. Pero uno podría imaginar que hay un algodón que las rodea y les quita espacio. Sin esa limitante, las mitocondrias comienzan a estirarse. Se mueven y fluctúan en sus posiciones. Solo hace falta quitar el algodón”.
Referencias
Fernández Casafuz, A.B., De Rossi, M.C. & Bruno, L. Mitochondrial cellular organization and shape fluctuations are differentially modulated by cytoskeletal networks. Scientific Reports 13, 4065 (2023).
*Luciana Bruno
Física y doctora en Ingeniería por la Universidad de Buenos Aires, Luciana Bruno completó (con una beca de la Fundación YPF) un segundo doctorado en Física en la Universidad de Rennes 1, Francia. “Descubrí el mundo de las imágenes de microscopía de fluorescencia y me encantaron, así que quise seguir mi carrera con temas relacionados a ese”, describió. Su ingreso a Carrera fue en 2006 (“para trabajar en el estudio del transporte intracelular mediado por motores moleculares”) y actualmente es investigadora Independiente del Conicet, en el área de Sistemas complejos del Instituto de Cálculo de la Facultad de Ciencias de Exactas y Naturales (UBA).



