El “abrazo” del ARN del dengue a una proteína decisiva en la replicación viral
2023
Mehrnoosh Arrar
El “abrazo” del ARN del dengue a una proteína decisiva en la replicación viral, según un nuevo trabajo de expertos de Exactas en Nucleic Acids Research
En base a un modelo atomístico de dinámica molecular, expertos del Instituto de Cálculo dilucidaron aspectos novedosos sobre la replicación del virus del dengue, ahora publicados en la revista Nucleic Acids Research. Enfocados en el estudio de la helicasa NS3, una proteína que para funcionar toma “combustible” de la célula infectada, comprendieron cómo se genera la transferencia energética que da lugar al desdoblamiento del ARN del dengue. Por haberse centrado en una proteína fundamental para la multiplicación del virus en el organismo, el paper representa un aporte positivo para el desarrollo de nuevos antivirales.
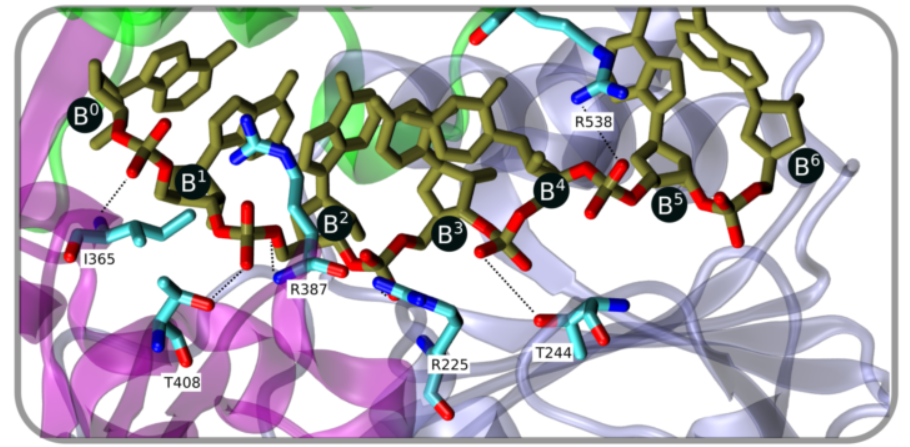
“Las proteínas que funcionan como motores moleculares se desplazan dentro de las células como si fueran trenes andando sobre vías. En nuestras investigaciones encontramos un caso en que la propia vía se pliega y abraza al motor molecular que se mueve sobre ella, acción que, llamativamente, termina siendo fundamental para que el propio motor se pueda desplazar”. Esta no es una enredada descripción onírica de aire ferroviario sino el modo en el que Mehrnoosh Arrar*, investigadora del CONICET y de la Facultad de Ciencias Exactas y Naturales de la UBA, describió una escena de escala microscópica que con su equipo de trabajo busca desentrañar: aquella en la que un motor molecular, la proteína helicasa NS3 del virus del dengue, se prepara para avanzar sobre una vía, el ARN de este patógeno, lo que permite nada menos que su replicación.
El objetivo de Arrar es ambicioso: comprender, a través de una suerte de “recreación escénica” de modelado molecular, los detalles mecánicos que subyacen a la transferencia de energía en la replicación del virus del dengue, pero puntualmente a partir de la acción de una proteína concreta, la helicasa NS3, cuyo rol protagónico en la multiplicación viral -algo ya descripto en la literatura- la tiene posicionada como un apetecible blanco terapéutico.
El logro de la investigadora y sus colegas reportado recientemente en la revista Nucleic Acids Research fue arribar a algunas precisiones que clarifican las condiciones en que ocurre lo que Arrar llamó “una película de apenas unos nanosegundos”: ese instante en que la helicasa consigue el “push-up” energético que le permite impulsar la replicación del virus, proceso en el que -según pudieron ver- el ARN del dengue juega un papel mucho más importante de lo que se creía.
Cuestión de distancia
Una de las preguntas centrales en este campo de estudio se relaciona a la distancia que separa dos puntos muy importantes de la helicasa: en uno, la proteína se acopla con lo que vendría a ser el “combustible” del que se sirve para ejecutar su rol, mientras que el otro es el lugar de contacto de la helicasa con el ARN, donde justamente se pone en juego la energía tomada en el sitio anterior. Pero, ¿de qué manera se da la transferencia de energía entre uno y otro lugar?, se vienen preguntando los expertos.
Hace tiempo se sabe que la helicasa recarga “combustible” gracias a su unión con un nucleótido trifosfato presente en las células, llamado ATP (la sigla de adenosín trifosfato, o trifosfato de adenosina). Por su interacción con la helicasa, el ATP sufre un proceso químico llamado hidrólisis, que es básicamente una reacción química en la que por acción del agua, un enlace de la molécula se rompe, lo que libera una gran cantidad de energía; justamente, aquella que la helicasa aprovecha para deslizarse sobre el ARN e impulsar el desdoblamiento de las hebras con material genético.
Dos modelos moleculares
Este “ABC” es central por lo que viene después. Primero, la generación de la copia del material genético. Segundo, la replicación del virus del dengue en el organismo, lo que se traduce en un aumento de la carga viral del paciente infectado y, en muchos casos, en la aparición de sintomatología asociada, con consecuencias variadas para la salud.
Pero también estos conceptos permiten entender la importancia del paper publicado por el equipo del Instituto de Cálculo de la UBA, que se titula “Impact of bound ssRNA length on allostery in the Dengue Virus NS3 helicase” (“Impacto de la longitud del ssRNA unido en el alosterismo en la helicasa NS3 del virus del dengue”).
En un trabajo anterior, este grupo de expertos había generado un modelo atomístico de dinámica molecular que recreaba la “película” de unos nanosegundos mencionada por Arrar. Lo hicieron en base a tres escenarios distintos: en presencia y en ausencia de ATP, y en presencia de los productos de la hidrólisis de ATP, es decir, ADP y fosfato inorgánico. El objetivo fue comparar los cambios dados por la interacción entre la helicasa y el ARN del virus tras la unión de la molécula de ATP y después de su hidrólisis. O, como graficó Arrar, “ver las diferencias entre el principio y el final de la película”.
Sin embargo, para sorpresa de los investigadores, no se apreciaron grandes cambios en la helicasa entre los modelos comparados.
Las preguntas surgieron de inmediato: ¿Es que no hay comunicación o transferencia de energía entre los dos sitios o -en cambio- interviene algún otro fenómeno?
Un abrazo de nucleótidos
Si bien ya era sabido que la cadena genética del dengue posee unos 11.000 nucleótidos, la ciencia tenía identificados solo 7 unidos a la helicasa estudiada. A esa noción se sumó hace un tiempo la evidencia experimental de uno de los autores de este paper, según la cual la helicasa en realidad ocupa un sitio mayor (de entre 10 y 11 nucleótidos) sobre el ARN viral.
Impulsados por esta idea, en este nuevo paper, los investigadores hicieron una pequeña apuesta: en lugar de modelar los 7 nucleótidos conocidos, probaron “alargar el ARN mediante la introducción de más nucleótidos por los costados”, explicó Arrar, y completó: “Lo hicimos sin tener ninguna evidencia estructural, con el objetivo de observar si se veían cambios en la helicasa, en presencia o en ausencia de ATP”.
Probaron con 11 nucleótidos, con 16 y hasta con 26, “¡Lo que vimos fue muy sorprendente y es que el largo del ARN cambia todo!”, dijo Arrar, con entusiasmo. “Con 7 nucleótidos no veíamos un efecto en la interacción; o sea, no se podía observar una comunicación entre los sitios, pero cuando cambiamos a un ARN de 16 o 26 nucleótidos, los cambios fueron muy marcados termodinámicamente, lo que prueba que uno y otro sitio de acople están afectados”, resumió.
Al encontrar que los nucleótidos en contacto con la proteína son más, se pudo deducir que la hebra de ARN de algún modo “abraza” la helicasa NS3.
Reforzar y soltar, un ritmo preciso
Además descubrieron una novedad con respecto a la dinámica de los “enganches”, ya que notaron que en presencia de ATP, el contacto helicasa-ARN tiende a aflojarse, mientras que luego de la liberación de los productos (en ausencia de ATP) ocurre lo opuesto: la unión se refuerza.
Como la helicasa está permanentemente tomando energía de las moléculas de ATP presentes en la célula, se produce un ciclo dinámico de afloje-refuerzo en ese “abrazo” del ARN, producto de los cambios en la transferencia de energía. El ritmo resultante impulsa los “pasos” que la helicasa va dando sobre la superficie del ARN (el tren sobre las vías del comienzo de estas líneas) lo que le permite desenrollarlo y hacer que esté disponible el material genético para que puedan concretarse distintos procesos involucrados en la replicación del virus. Entre ellos, que se genere la famosa copia.
“Si el ARN fuese más corto y no se enrollara sobre sí mismo, no se precisaría una helicasa, pero en la medida en que no es así, la helicasa termina cumpliendo un rol clave en las etapas de replicación viral y, por lo tanto, en las infecciones”, enfatizó la investigadora, antes de concluir: “Entender el mecanismo de esta proteína es central para generar un aporte a largo plazo y diseñar mejores fármacos con efecto antiviral”.
No es una meta menor, considerando los pasos cautelosos que todavía da la industria farmacéutica para generar una vacuna eficaz y accesible que cubra los cuatro serotipos del dengue, enfermedad que genera nada menos que 400 millones de contagios anuales en el mundo.
Referencias
Amrein, F.; Sarto, C.; Cababie L.A.; González Flecha, F.L.; Kaufman, S.B.; Arrar, M. Impact of bound ssRNA length on allostery in the Dengue Virus NS3 helicase, Nucleic Acids Research, Vol. 51, pp. 11213–11224 (2023).
* Mehrnoosh Arrar es química por la Universidad de Florida, Estados Unidos, país del que es originaria. Realizó un doctorado especializado en fisicoquímica en la Universidad de California-San Diego y, desde 2018, tras arribar a la Argentina en 2014 para realizar un posdoctorado, se desempeña como investigadora Asistente del Conicet en el área de Modelado molecular del Instituto de Cálculo de la Facultad de Ciencias Exactas y Naturales de la UBA.



